2017-08-01
现在我们当然有理由这么认为,因为各种指南已经明确,胆固醇是导致动脉粥样硬化性疾病(ASCVD)的主要原因,健康人每日胆固醇的摄入量不要超过300毫克,而心脑血管疾病的高危人群还应该进一步控制胆固醇的摄入。而人类和胆固醇的战争早已在100多年前就打响了。从1904年德国莱比锡病理学家Felix Marchand第一次提出“动脉粥样硬化”起至今,人类开始了研究胆固醇与ASCVD的百年循证之路。
100年前尸体解剖的惊人发现

阿道夫·奥托·赖因霍尔德·温道斯博士(德语:Adolf Otto Reinhold Windaus,1876-1959)
1910年,德国化学家“类固醇之父”阿道夫·温道斯在尸体解剖中发现,冠心病患者主动脉壁的粥样斑块内含有大量胆固醇,含量为正常人的20~26倍。他及时向世人报告了这个伟大发现,甚至大胆地预测,胆固醇的升高很可能是促使动脉粥样硬化斑块的一个潜在原因。其实早在1901年温道斯便开始进行胆固醇结构的研究和测定工作(这是他从博士学位研究以来所关注的一个题目),持续了约30年。他在1903年发表了第一篇题为《胆甾醇(胆固醇)》的首创性论文。
然而,温道斯的研究结果仅发表在德国国内一份毫不起眼的学术杂志上,再加上温道斯使用的是他的母语德语,因此这个发现尽管意义非常,但学术影响却相当有限,难以被人们所关注。有趣的是,三年后(1913年),对温道斯的发现毫不知情的病理学家阿尼茨科夫(Anitschkow),无心插柳,证实并丰富了温道斯的发现。
首个家兔动脉粥样硬化模型
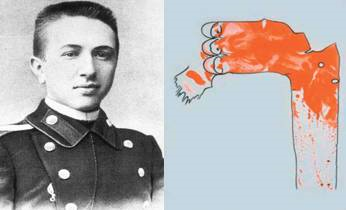
苏联病理学家阿尼茨科夫(Anitschkow,1885-1964)以及当时手绘的手绘动脉粥样硬化家兔主动脉标本
1913年,前苏联病理学家阿尼茨科夫公布了一项著名的动物实验结果,草食动物家兔进食含大量胆固醇和脂肪的食物后,可在短期内发生动脉粥样硬化。但就是这样一个小小的动物实验,让当时学术界流行的两大学术观点几近崩溃。他没有受到当时非常时髦的学说——“蛋白质毒性”学说的束缚,而是独辟蹊径,把目光从当时的科学宠儿蛋白质转到了被世人所忽视的胆固醇上来,决定用从蛋黄中提炼的胆固醇(而不是包括蛋白的整个鸡蛋)来喂养家兔。70天后,阿尼茨科夫惊奇地发现,高胆固醇喂养家兔的主动脉弓内布满了脂质条纹,无论是外观形态还是显微镜形态,均与人动脉粥样硬化病理形态高度一致。这个结果不仅动摇了当时无所不能的“蛋白质毒性”学说,也推翻了动脉粥样硬化只发生在“老年兔”的观点。
40年的弯路,动脉粥样硬化动物模型的建立
阿尼茨科夫的成功激发了人们的兴趣,后继者尝试在其他动物身上重复同样的实验。然而,最常见的实验动物——鼠的研究结果却令人失望。 1938年,威伦司(Wilens)和斯普劳尔(Sproul)以高胆固醇喂养大鼠长达700天,仍未在这些大鼠身上发现任何动脉粥样硬化迹象。这给支持阿尼茨科夫的学者泼了一瓢冷水,该实验也再次提示,在自然状态下,高胆固醇饮食并不能诱发大鼠动脉粥样硬化。1952年,(哈特罗夫特)Hartroft等人做了一项有趣的实验,首次尝试给大鼠喂养低胆碱饮食。胆碱是肝脏消除胆固醇的必备物质。结果发现,低胆碱饮食的大鼠中发生了动脉粥样硬化。这个实验结果启发了部分学者,使他们对之前高胆固醇饮食大鼠动脉粥样硬化模型的失败原因进行了重新审视。原来,天然的大鼠之所以不会因进食高胆固醇饮食而发生动脉粥样硬化,是因为大鼠更接近于肉食动物,这类动物能高效代谢饮食中摄取的胆固醇,从而防止了血液中胆固醇水平的升高,避免了动脉粥样硬化的发生。
直到1954 年,马利诺夫(Malinow)等在给予大鼠“二合一”饲料,即高胆固醇饮食的同时,加用抑制甲状腺素合成的抗甲亢药物甲硫氧嘧啶。试验鼠血浆胆固醇水平显著升高,这些大鼠均发生了动脉粥样硬化。同年,威斯勒(Wissler)的研究小组给予大鼠“四合一”复合饮食配方,即由脂肪、胆固醇、胆碱和硫脲嘧啶组成的食物饲料。结果在93只大鼠中,有31%的大鼠冠状动脉内膜下发现脂质沉积,即动脉粥样硬化斑块。至此,人类完成了动脉粥样硬化小鼠模型的建立。
胆固醇与两个诺奖
随后整个胆固醇研究的核心问题就是:我们的肝脏是如何合成胆固醇的?出生于德国、由于纳粹反犹主义迫害而移民美国的犹太生化学家康拉德•布洛赫(Konrad Emil Bloch)几乎是以一己之力在50年代揭示了胆固醇合成的整套机制:这是一套从一个名为“乙酰辅酶A”的原料开始的、拥有三十多步酶催化反应的复杂系统。这些复杂反应步骤像流水线一样被井然有序地安排在人体最大的化工厂——肝脏中进行。布洛赫因此也获得了1964年的诺贝尔生理学或医学奖。值得注意的是,布洛赫是和发现胆固醇合成的原料——乙酰辅酶A——的德国科学家费奥多•吕南(Feodor Lynen)共享的这一奖项。在1964年诺贝尔奖颁奖典礼上,颁奖致辞中这么评价布洛赫的发现:“您的发现可能为我们提供了对抗一种人类痼疾——心血管疾病——的有力武器。您的成就使得我们展望未来的时候可以期待,有一天人类不仅仅能够改善我们的生活条件,还可以改善我们自身。”
那么,胆固醇合成的调节机制是什么呢?我们的身体是如何指挥肝脏合成和降解胆固醇,又是怎样做出这些决定的?高胆固醇疾病是否就是因为这些机制出了错误呢?时间来到了1972年,两个刚刚在美国德克萨斯州的达拉斯健康科学中心(The University of Texas Health Science Center at Dallas,后更名为西南医学中心)找到教职并建立实验室的年轻人,决心用自己的智慧和勇气解决胆固醇合成的调节机制问题。这两位三十出头的年轻人是来自南方的裁缝之子约瑟夫•高尔斯坦(Joseph Goldstein)和来自纽约的销售员之子麦克•布朗(Michael Brown)。因为他们的姓氏,不少中国科学家和学生亲切的称呼他们“金老头”和“棕老头”。

1975年的“金老头”(右)和“棕老头”(左)

如今的“金老头”(左)和“棕老头”(右),他们共同合作了40年
1976年,高尔斯坦和布朗利用家族性高胆固醇血症患者(FH)的细胞,证明低密度脂蛋白确实可以与细胞表面结合,并被细胞“吞噬”。而患者细胞无法结合并吞噬低密度脂蛋白,从而导致了严重的高胆固醇血症。1978年,高尔斯坦和布朗与日本科学家远藤章(Akira Endo)合作,证明了远藤刚刚发现的一种化学物质确实能够有效抑制HMG辅酶A还原酶的活性,从而为这种物质进入临床应用打开了大门。这种物质是什么,相信大家都猜到了,就是他汀!1979~1982年,他们的学生沃尔夫冈•施耐德(Wolfgang Schneider)成功地分离并纯化出之前存在于假想中的、位于细胞表面并可以结合低密度脂蛋白的物质,并命名为低密度脂蛋白受体(LDL receptor)。1985年,为表彰他们对胆固醇代谢的调节机制的重大发现,他二人共同获得1985年诺贝尔医学奖。
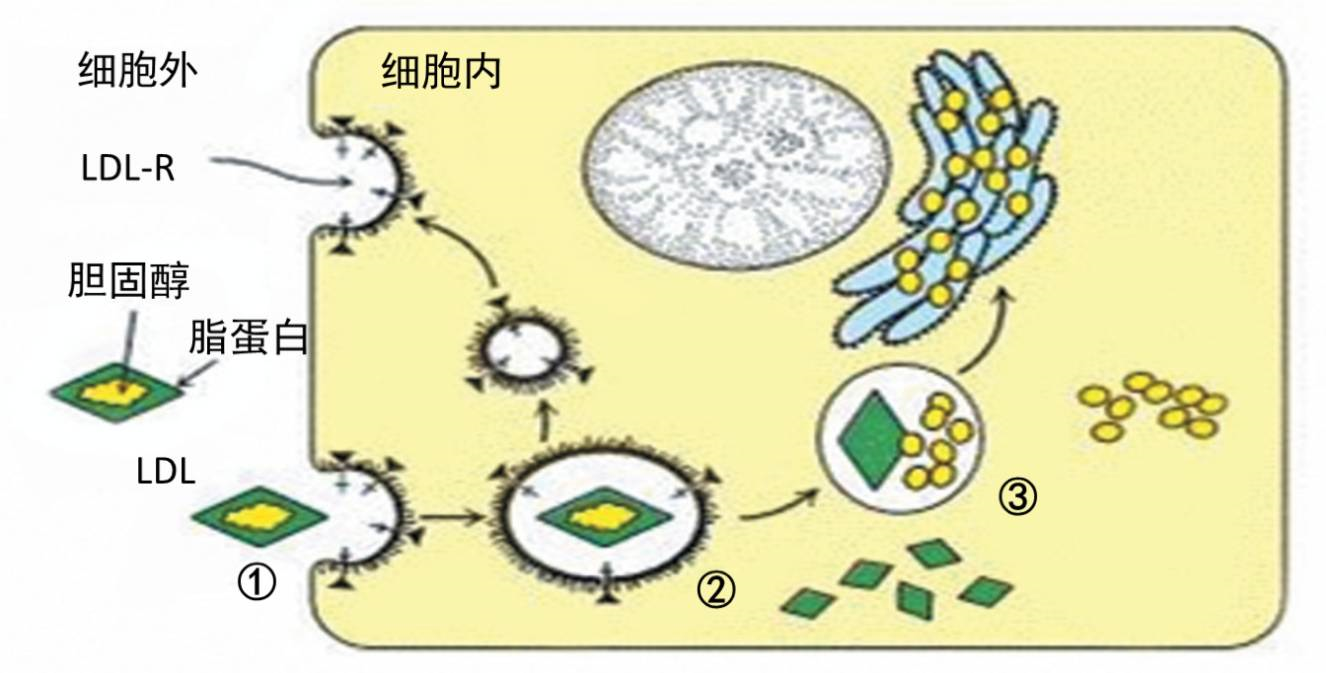
经典LDL-R介导的胆固醇内吞理论:①血液中低密度脂蛋白(LDL)与细胞膜上LDL受体(LDL.R)结合;②结合了LDL.R的LDL被内吞进入细胞内;③LDL被细胞内的溶酶体水解(降解)。而我们之前提到的FH患者,就是由于LDL.R突变基因导致其功能缺陷,妨碍LDL体内代谢清除,导致血液中LDL.R水平过高,进而诱发动脉粥样硬化。
后他汀时代的战争
随着胆固醇理论的不断完善和他汀的出现,人类已经掌握了对抗胆固醇的有利武器。但这场战争远未结束,心血管疾病依旧是目前危害人类健康的第一杀手。被誉为和“阿司匹林”及“青霉素”之后最伟大的药物之一的他汀,伴随其30年的神奇历史,将继续帮助人类对抗胆固醇,而他汀的出现以及推广历史,我们也将在随后的文章《众里寻“他”——他汀30年》中为大家详细介绍。
- 上一篇: 【Neurology】心健康,脑健康,做到这7条让你终身受益
- 下一篇: 老年患者心血管药物合理应用








 微信扫一扫关注公众号
微信扫一扫关注公众号